FISICOQUÍMICA EXACTAS Ley de difusión de Graham
La ley de Graham enuncia que la velocidad de efusión es inversamente proporcional a la densidad del gas según: Para dos gases cualesquiera (siendo K la constante de proporcionalidad) : Graham dio con otra forma de calcular pesos moleculares de gases a partir de medidas experimentales. . Utilizando la ecuaciones de los gases ideales despejamos.
Graham's Law Diffusion and Effusion Daily Life Examples What's Insight

En esta lección se estudia la Ley de Difusión de los Gases Ideales o Ley de Graham. Se resuelve un ejemplo en el que se solicita determinar la velocidad de d.
FISICOQUÍMICA EXACTAS Ley de difusión de Graham
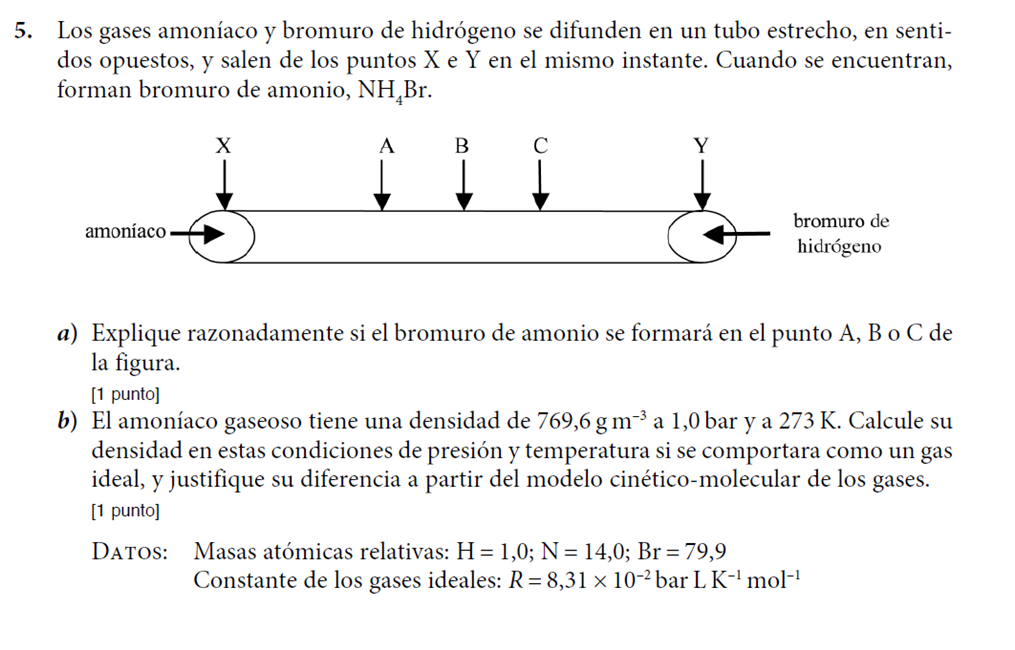
La ley de difusión de Graham establece que la relación de la velocidad de difusión de dos gases es la misma que la relación de la raíz cuadrada de la masa molar de los gases. Ejemplo 9.16.1 9.16. 1: Effusion Rates. Calcular las tasas relativas de derrame de He ( g) y O 2 ( g ).
LEY DE GRAHAM, VELOCIDAD DE DIFUSIÓN Y EFUSIÓN DE GASES YouTube

Un proceso que implica el movimiento de especies gaseosas similar a la difusión es la efusión, el escape de las moléculas de gas a través de un pequeño agujero como un agujero en un globo hacia el vacío (Figura 9.4.1 9.4. 1 ). Aunque las velocidades de la difusión y la efusión dependen de la masa molar del gas involucrado, sus.
CLUSTER divulgación científica Difusión de gases. Ley de Graham
Si el vídeo te sirvió comparte, comenta y suscríbete eso nos ayudaría mucho para seguir creciendo y ofrecer materiales de estudio de mejor calidad. Recordar.
Ley De Graham Modelo atomico de diversos tipos

#profeedi realiza una explicación sobre difusión y efusión de gases, descrita mediante la Ley de Graham, que relaciona la rapidez de difusión (o efusión) de.
Ley de Difusion de Gases. Ley de Graham YouTube

Para dar a la ley de Graham explicación más detallada hemos de decir que el fenómeno de fusión está relacionado con la energía cinética de las moléculas.Debido a su movimiento constante, las partículas se distribuyen uniformemente en un solo espacio en el espacio libre. Si hay una aglomeración de partículas más grande en un punto, habrá más choques entre sí, por lo que se.
Guía completa de la fórmula de Graham para difusión y efusión YuBrain

Un proceso que implica el movimiento de especies gaseosas similar a la difusión es la efusión, el escape de moléculas de gas a través de un pequeño orificio, como el de un globo, hacia el vacío ( Figura 9.28 ). Aunque las velocidades de difusión y efusión dependen de la masa molar del gas involucrado, sus velocidades no son iguales; sin.
Ley de Difusión de Graham PDF

Ley de Derrame de Graham. Inserte un tabique en un extremo hembra cónico estándar 14/20 de un adaptador de destilación al vacío insertado en un matraz redondo de 50 mL. Acople el adaptador de vacío a una bomba de vacío. Llene las jeringas con freón e hidrógeno y, a su vez, inserte la aguja de cada jeringa a través del tabique.
5.5 Ley de efusión de Graham YouTube

Relación de las tasas de efusión o difusión de dos gases. La fórmula de Graham también se puede expresar de una manera distinta para relacionar las tasas de efusión de dos gases diferentes bajo las mismas condiciones. Esto permite comparar, por ejemplo, cuál de los dos gases se escapa más rápidamente cuando ambos están contenidos en.
LEY DE DIFUSIÓN DE LOS GASES GRAHAM FORMULARIO YouTube

Esto se conoció como la Ley de Graham , y establece que la tasa de efusión de un gas es inversamente proporcional a la raíz cuadrada de su masa molecular. Por lo general, esta fórmula se usa para comparar las tasas de dos gases diferentes a temperaturas y presiones iguales. La razón de la tasa (o velocidad) del gas A sobre el gas B es.
QUIMICA Ley de difusion de GRAHAM YouTube

Ley de difusión de Graham. La difusión es el proceso por el cual una substancia se distribuye uniformemente en el espacio que la encierra o en el medio en que se encuentra. Por ejemplo: si se conectan dos tanques conteniendo el mismo gas a diferentes presiones, en corto tiempo la presión es igual en ambos tanques.
(35/20) LEY DE GRAHAM, DIFUSION , EJERCICIO CORTO, GRAHAM'S LAW, DIFFUSION, SHORT EXERCISE YouTube

Mayo, 2014. Ley de difusión de Graham La difusión es el proceso por el cual una substancia se distribuye uniformemente en el espacio que la encierra o en el medio en que se encuentra. Por ejemplo: si se conectan dos tanques conteniendo el mismo gas a diferentes presiones, en corto tiempo la presión es igual en ambos tanques.
LEYES DE LOS GASES. LEY DE GRAHAM.
Ejemplo 14.15.1 14.15. 1. Calcular la relación de las tasas de difusión de gas amoníaco (NH3) ( NH 3) a cloruro de hidrógeno (HCl) ( HCl) a la misma temperatura y presión. Solución: Paso 1: Enumere las cantidades conocidas y planifique el problema. Conocido. Masa molar NH3 = 17.04g/mol NH 3 = 17.04 g/mol.
Ley de La Difusión de Graham PDF

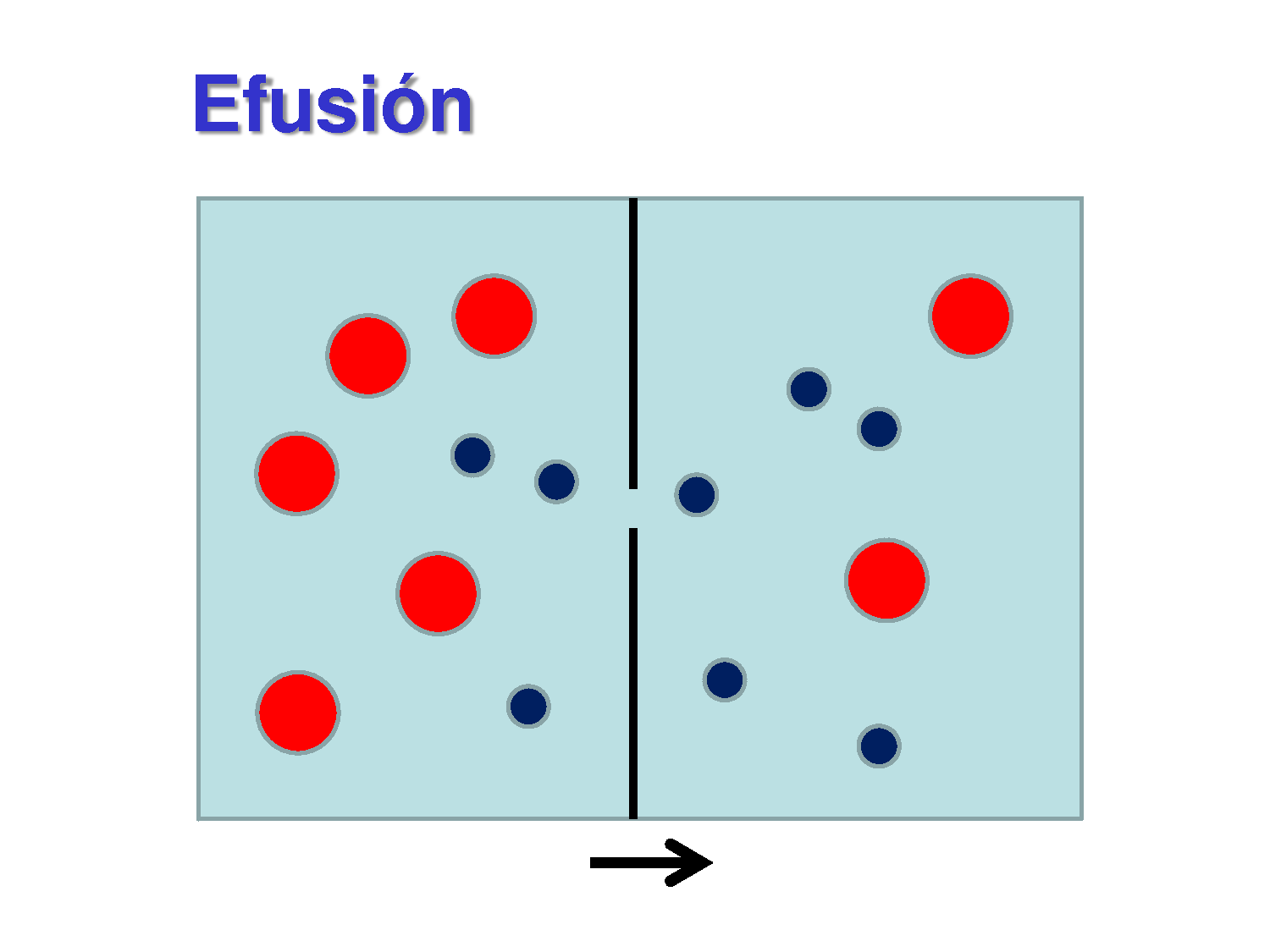
El derrame es el escape de moléculas de gas a través de una pequeña abertura hacia un compartimento vacío. La ley de Graham dice que (Tasa de gas de efusión 1/Tasa de gas de efusión 2) = (M de gas 2/ M de gas 1) 1/2 M = masa molar de los gases. Además, no se definen las unidades para la tasa de derrame. Virtual se puede usar cualquier.
Ley de difusión de Graham YouTube

Ejemplo 3: Ley de difusión de Graham. Un ejemplo de la ley de difusión de Graham ocurre cada vez que alguien huele algo a una distancia significativa de su fuente. Por ejemplo, John puede oler una cafetería o una panadería cuando pasa, incluso en un día sin viento. Esto se debe a que las moléculas vaporizadas del café y los productos.